Занятие 1. Кислоты и щелочи.
Переход от ботаники к химии. Объяснение связи наук и важности химии для понимания жизненных процессов.
Вспоминаем одно из последних занятий по ботанике — выделение цветных пигментов из осенних листьев. Зеленый — хлорофилл, красный — антоциан, желтый — ксантофил. Рассматриваем пленку высохших пигментов на поверхности пластиковых банок, в которых их выделяли.
Демонстрация. Экстракт вареной красной капусты — универсальный индикатор кислотности — антоциан. Антоцианы — группа пигментов, обладающих спектром окраски от красного до синего. В нейтральной среде он сине-фиолетовый, при добавлении кислоты (из лимона или уксус) индикатор становится розовым. При добавлении слабой щелочи (сода) индикатор становится сине-зеленым, при добавлении сильной щелочи (КОН = гидроксид калия) раствор становится зеленым.
Все делают свои эксперименты в стаканах и сравнивают, у кого получился какой цвет.
Второй эксперимент — с индикатором фенолфталеином. Бесцветный прозрачный индикатор, изменяющий цвет только в щелочной среде — становится ярко-малиновым.
Добавляем несколько капель к щелочному раствору — появляется малиновый цвет. Потом постепенно добавляем кислоту в раствор, и как только рН становится нейтральным, раствор снова становится прозрачным. Если снова добавить щелочь, снова появится малиновый цвет. И так можно сделать несколько раз. «Побеждают» по очереди то кислота, то щелочь, в зависимости от того, каких ионов больше — водорода (Н) или гидроксила (ОН).
Теория. Объяснение строения молекулы воды (повторение) — Н2О. Говорим про строение атома водорода — ядро, протон, электрон. Используем химический конструктор из шариков-атомов разного цвета. Твердое-жидкое-газообразное состояние вещества. Способность молекулы воды «рваться» в химической реакции. Образование свободного атома водорода (иона Н) и гидроксила ОН. При химической реакции другие вещества могут ускорять процесс разрыва молекул воды (диссоциации) и смещать равновесие в количестве Н и ОН. В случае увеличенного количества Н в растворе получается кислота, в случае увеличенного количества ОН получается щелочь.
В присутствии кислоты индикатор (антоциан) испытывает химическое превращение и изменяет окраску на розовую, в присутствии щелочи — на зеленую.
Кислотность. Чем больше ионов водорода в растворе, тем более кислая получается среда. Чем больше гидроксилов, тем более щелочная. Если ионов Н и гидроксилов в растворе поровну, среда получается нейтральная.
Линейка рН. Ученые придумали специальную линейку для обозначения кислотности среды — от 1 до 14. рН1 — самая сильная кислота, рН14 — самая сильная щелочь. Посередине — 7 — нейтральная среда. Большинство биологических процессов происходят при рН6.5-7.5, то есть в нейтральной среде. Самое понятное и известное исключение — желудочный сок, где рН1.5-2.
Занятие 2. Газы
Продолжение предыдущей темы. Повторяем про воду, кислоту и щелочь.
Переходим к газам. Атом водорода, атом кислорода. Разница между атомом и молекулой газа Углекислый газ (СО2), строение молекулы. Сходство с молекулой воды, но разные атомы. Выделение СО2 при дыхании и горении. Поглощение СО2 растениями для создания глюкозы и выделения другого газа — кислорода (О2). Необходимость кислорода для всех (почти) живых организмов. Упоминание бактерий, живущих в бескислородной среде. Необходимость кислорода для горения. Невозможность костра на Луне.
Демонстрация. Выделение углекислого газа и кислорода.
-
СО2. Для выделения СО2 мы использовали соду и кислоту. Всем розданы стаканы, добавлена ложка соды и вода, растворение соды. После этого к раствору соды добавлена уксусная кислота (уксус) и мы наблюдаем химическую реакцию с выделением СО2. Чтобы убедиться в свойствах этого газа, мы опускаем в полупустой стакан с реакцией (в газ) горящую спичку — она тухнет. После этого каждый аккуратно переливает газ (не жидкость) из своего стакана в другой стакан с горящей «чайной» свечкой (tea candle) – свеча тоже тухнет. СО2 тяжелее воздуха, поэтому он остается в стакане, а не улетучивается (если стакан не трясти) и его можно перелить из одной емкости в другую. Но через некоторое время он все равно смешивается с воздухом и «перестает работать» как тушитель огня. Говорим об использовании сжатого СО2 в огнетушителях. Также о необходимости проветривания помещений, где находится много людей — для доступа свежего воздуха, обогащенного кислородом.
-
О2. Для выделения кислорода мы использовали перекись водорода (Н2О2) и марганцовку (перманганат калия). При добавлении раствора марганцовки к перекиси проходит бурная реакция с выделением газа — кислорода, и выделением тепла (стакан нагревается). Проверяем свойства газа — опускаем горящую спичку в стакан — она разгорается намного ярче. Опускаем тлеющую лучинку — она вспыхивает ярким пламенем. Это происходит 2-3 раза, но потом кислород заканчивается — он превращается в СО2. Для возобновления эффекта необходимо добавить новых реагентов — перекиси водорода и марганцовки. Аналогичная реакция возникает при добавлении кристаллов марганцовки к раствору перекиси водорода, но с большим выделением тепла и паров воды. Смысл реакции в том, что марганцовка разлагает перекись водорода — «отрывает» от нее кислород, а сама превращается в другое соединение. Но мы в дальнейшие тонкости не вдавались. Если кому-то интересно, то формула реакции — KMnO4 + H2O2 + H2O = O2 + MnO2 + KOH
Обсуждение экспериментов. Взрывоопасность чистого кислорода. Опасность СО2.
Обсуждаем и записываем 3 основных признака химической реакции
-
Изменение цвета реакции
-
Изменение температуры реакции
-
Выделение газа
Занятие 3. Продолжение темы Газы.
Повторение прошлого занятия. Строение атома и молекулы кислорода. СО2.
Обсуждение строения атома в целом. Атом водорода. Молекула. Самый легкий газ.
Демонстрация. Выделение водорода.
Используем алюминиевую фольгу. Каждый скатывает небольшие шарики из фольги и складываем их в бутылку. Заливаем шарики жидкостью для прочистки канализационных труб, которая содержит высокую концентрацию щелочи (NaOH) или чистую щелочь. Натягиваем на горлышко бутылки воздушный шарик и оставляем на некоторое время. Начинается реакция (выделяются пузырьки газа), которая занимает некоторое время — чтобы шарик надулся до размера 20-25см.
После того, как шарик достаточно надут, завязываем его — он наполнен водородом. Надуваем ртом еще один шарик похожего размера и тоже завязываем — он надут воздухом с повышенным содержанием СО2 (параллельно говорим о составе воздуха).
В темноте поджигаем шарик с воздухом — он лопается с тихим хлопком и ничего не видно. Потом поджигаем шарик с водородом — он лопается с громким хлопком и ярким коротким пламенем — маленький взрыв! Обсуждаем опасность эксперимента, говорим о дирижаблях, взрывах и воздушных шарах.
Для «закрепленя материала» о газах проводим традиционный эксперимент с elephant’s toothpaste. Используем перекись водорода, дрожжи, жидкое мыло (Fairy)/ Смешиваем дрожжи с водой, растворяем. В другой емкости смешиваем перекись водорода с жидким мылом. Каждый получает по 2 маленьких стакана и 1 большой. Наливаем в один маленький стакан раствор дрожжей, в другой — перекись с мылом. После этого аккуратно сливаем содержимое маленьких стаканов в большой и наблюдаем за реакцией. Появляется быстро растущая пена, заполняющая весь большой стакан и даже переливающаяся через край. Объем увеличивается в 10+ раз.
Обсуждаем эксперимент. В дрожжах содержится белок (вещество), так же разлагающее перекись водорода, как и марганцовка. При этом выделяется кислород. Когда он пытается улететь из реакции, он встречается с раствором мыла и создает огромное количество (миллионы!) микроскопических мыльных пузырей, которые растут и создают пену. И мы это видим как продукт реакции.
Занятия 4 и 5. Кристаллы.
Благодаря прошлогоднему успеху с выращиванием кристаллов медного купороса (синего цвета), в этом году мы попробуем вырастить кристаллы обычной соли. Совсем безвредно и легко повторяемо. Вместе с кристаллами соли попробуем вырастить «magic tree”, похожее на те, что продаются заготовками в коммерческих наборах.
Теория. Кристаллы в жизни. Кварц, песок, алмазы, соль. Съедобность и прочность. Источники соли — морская соль и камення соль. Натрий и хлор как компоненты кристалла.
Кристаллическая решетка поваренной соли:
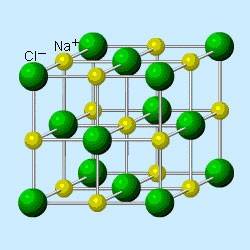
При растворении соли молекулы воды «отрывают ионы Na и Cl от кристалла и ионы умещаются «между молекулами» воды. Соль можно растворять до определенного предела — концентрации, после чего она больше не растворяется, а остается в виде осадка. Такой раствор называется насыщенным. В нем больше нет места для новых ионов между молекулами воды. Если такой раствор нагреть, то места становится больше и можно растворить больше соли, сделав его перенасыщенным. При остывании раствора излишки соли выпадают в виде микроскопических кристаллов, которые растут по мере продолжения остывания и затем испарения воды. Мы воспользовались этим свойством, чтобы начать растить кристаллы — затравки.
Демонстрация. Кристаллы крупной каменной соли. Растворение нескольких ложек соли в холодной и горячей воде. Растворение такого же количества соды — разная растворимость солей. Растворимость сахара.
Подготовка к домашней работе.
-
Дети получили пластиковый контейнер (или блюдце) для высушивания кристаллов. Нужно растворить 3 полные столовые ложки соли в половине стакана/чашки горячей воды. Если делают вместе с родителями, то можно налить кипятка. Если сами — то горячей из крана, чтобы не обжечься. После этого перелить насыщеный раствор в контейнер/блюдце и оставить остывать. Можно прикрыть листом бумаги (неплотно), чтобы уменьшить количество попадающей из воздуха пыли. Крышка не должна быть плотной, чтобы вода свободно могла испаряться. За неделю-две вода должна испариться, оставив на дне слой кристалликов. Если повезет, мы используем их для роста более крупных кристаллов, если «повезет меньше», используем крупные кристаллы соли из магазина.
-
Выращивание кристаллов на картонном макете «дерева» = magic tree. Все получили набор из самостоятельно (или с моей помощью) вырезанного картонного дерева-елки, большого стакана/контейнера и пластиковой банки с синим раствором. Раствор состоит из поваренной соли, отбеливателя Mrs Stewart’s Bluing (привезенного из Америки!), и аммиачного раствора — ускорителя реакции. Жидкость нужно перелить из банки в большой пластиковый стакан/контейнер и поставить в жидкость расправленное дерево. Жидкость начнет подниматься вверх, благодаря силе поверхностного натяжения воды. Она теоретически должна достигнуть верха дерева. По мере достижения краев картона, вода начнет испаряться и по краям начнут расти тонкие кристаллы. Если жидкость будет испаряться слишком быстро из контейнера, можно добавить в него немного горячей воды (не кипятка!) и продолжать наблюдения.